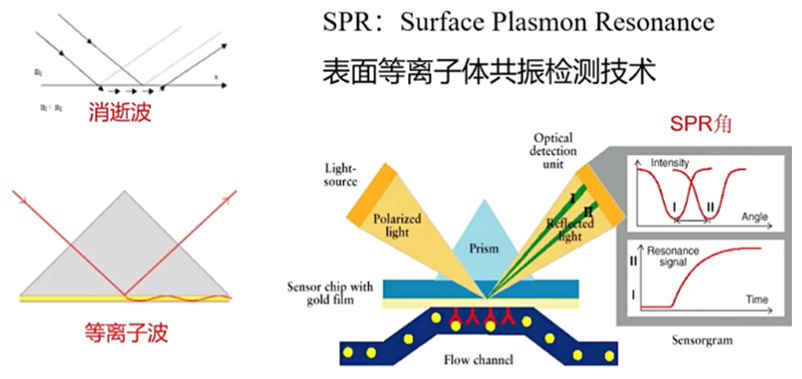
分子间相互作用强度和模式在药物研发中是衡量候选药物的重要指标。SPR芯片是一个带有葡聚糖(Dextran)的金属表面(Mental Surface),而配体蛋白(Ligand)的氨基端可以与葡聚糖结合从而被固定到金属表面。下方光源发出的一个单波长激光束进入到棱镜(Prism)中,导致多角度的光线入射到金属表面,几乎所有入射的光线都会发生反射,但有一个例外,在入射角达到某一个角度时,光子的能量会被金属吸收转化成表面等离子体波,在这个角度没有光线被反射出来,而是以很小的强度被检测器检测到,这个角度被称为共振角。由于等离子体波会在金属表面传播,所以金属表面偶联的配体蛋白与任何物质(这里固定的叫做配体ligand而流动相里面不是ligand叫做analyte)发生相互作用都将导致共振角发生改变。而共振角的该变量与Ligand-Analyte的数量成正比。因此,依据共振角的改变可以得到热力学的亲和常数Ka。
科缔思生物基于Biacore平台为客户提供准确、快速的亲和力测定服务,包括蛋白质-蛋白质的亲和力检测;抗体抗原亲和力检测;蛋白质与小分子药物亲和力检测;蛋白质-DNA亲和力检测等。
参考文献:
Chavanieu, A., & Pugnière, M. (2016). Developments in SPR Fragment Screening. Expert opinion on drug discovery, 11(5), 489–499. https://doi.org/10.1517/17460441.2016.1160888
Olaru, A., Bala, C., Jaffrezic-Renault, N., & Aboul-Enein, H. Y. (2015). Surface plasmon resonance (SPR) biosensors in pharmaceutical analysis. Critical reviews in analytical chemistry, 45(2), 97–105. https://doi.org/10.1080/10408347.2014.881250
