2.构象约束肽
2.2 订书肽
直链多肽很难保持原有的二结构,由于构象的不稳定导致其与靶点蛋白的结合能力有限,并且线性多肽较难透过细胞膜,且易被蛋白酶水解。研究表明,具有α螺旋结构和富含正电荷的多肽可以有效穿过细胞膜。2000年,Verdine GL团队在Grubbs的工作基础上,使用Grubbs催化剂,直接在固相树脂上对具有成对末端烯烃侧链的多肽进行RCM反应从而形成环烯桥系绳首次提出了订书肽概念。非天然氨基酸的α-双取代以及订书桥的形成使得订书肽有着较线性肽更高的α螺旋程度,使得其与靶点蛋白的结合能力增幅达到5-5000倍,此外,订书肽分子的穿膜能力也得到了提升, 同时很大程度上克服了舒张伸展状态下的线性肽易受到肽酶水解破坏的弱点,在生物体内的半衰期较长。
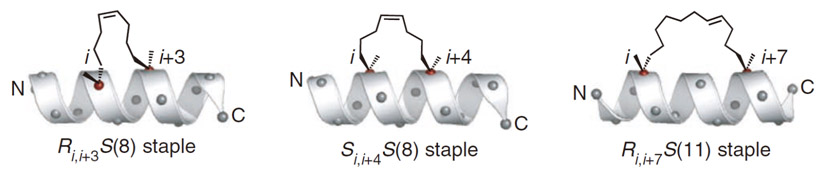
不同位点插入的订书肽示意图
非天然氨基酸的不适当插入可能会改变天然多肽与靶点结合的亲和力,因此,Sn、Rn氨基酸插入的位点选择尤为重要。科缔思生物可以根据所提供的原始多肽序列,通过计算机药物设计软件分析、丙氨酸扫描技术等位点筛选技术,为客户提供订书肽的设计、合成、纯化以及后续理化性质和生物活性表征等一系列技术服务。
参考文献:
Kim, Y. W., Grossmann, T. N., & Verdine, G. L. (2011). Synthesis of all-hydrocarbon stapled α-helical peptides by ring-closing olefin metathesis. Nature protocols, 6(6), 761–771.
https://doi.org/10.1038/nprot.2011.324
Kritzer J. A. (2010). Stapled peptides: Magic bullets in nature's arsenal. Nature chemical biology, 6(8), 566–567.
https://doi.org/10.1038/nchembio.407
Lau, Y. H., de Andrade, P., Wu, Y., & Spring, D. R. (2015). Peptide stapling techniques based on different macrocyclisation chemistries. Chemical Society reviews, 44(1), 91–102.
https://doi.org/10.1039/c4cs00246f
Whisenant, J., & Burgess, K. (2022). Synthetic helical peptide capping strategies. Chemical Society reviews, 51(14), 5795–5804.
https://doi.org/10.1039/d1cs01175h
Q1IF: 60.615
